Кислород какой газ. Формула кислорода структурная химическая
Это искусственно полученные и очень ценные в практическом отношении вещества - хлорфторуглеводороды разного состава, например такие:Эти вещества получают при реакциях замещения галогенами атомов водорода в углеводородах. Хлорфторуглеводороды - стойкие вещества, не растворяются в воде, неядовиты, не горят, не вызывают коррозии, отличные изоляторы. Из них делают утеплители для стен зданий, одноразовую посуду для горячих напитков. Жидкие вещества из этой группы (фреоны) - хоро-шие растворители, эффективные хладоагенты в холодильниках и кондиционерах. Их применяют в аэрозольных баллончиках как безвредные растворители специальных веществ, в системах ав-томатического пожаротушения (CBrF 3).Производство этих веществ развивалось ускоренными темпа-ми до тех пор, пока не обнаружили, что они, попадая в страто-сферу, разрушают озон (Сейчас стараются заменить фреоны на менее летучие вещества. Например, в качестве хладоагентов ис-пользуют фторхлорметан, а для аэрозольных баллонов применя-ют сжиженные газообразные предельные углеводороды).До стратосферы эти вещества доходят без изменений. Ведь они химически устойчивы. А в стратосфере, где много ультрафи-олетового излучения, их молекулы разрушаются, при этом от-щепляются активные атомы галогена, в частности хлора:
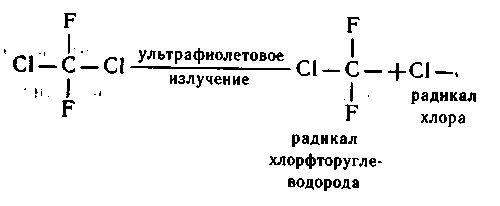
Одноатомный хлор-радикал реагирует с озоном:0 3 + Сl = О 2 + СlO
озон хлор кислород оксид (радикал) хлора (II)Под действием ультрафиолетовых лучей из озона образуется кислород, который в момент выделения также бывает в актив-ном одноатомном состоянии: 0 3 = 0 2 + Оозон кислород атомарный
кислородОксид хлора (II) реагирует с атомарным кислородом, и тогда вновь образуется хлор-радикал, который опять разрушает озон; происходит, цепная реакция, повторяющаяся многократно:СlO + О = Сl + О 2оксид атомарный хлор кислородхлора (II) кислород (радикал)О 3 + С1= О 2 + СlOОдин атом хлора участвует в серии таких реакций и может разрушить до 100000 молекул озона. Хлор может «выйти из иг-ры» тогда, когда ему встретится молекула метана. Тогда он, присоединив к себе один атом водорода из метана, образует хлороводород, который при растворении в воде образует соляную кислоту. Так хлор-разрушитель возвращается на Землю в виде кислотного дождя:СН 4 + 2С1 - СН 3 С1 + НС1метан хлор хлор хлороводород (радикал) метан (в растворе - соляная кислота)Даже если производство хлорфторуглеводородов будет повсе-местно сокращено, процесс разрушения озонового слоя над всей планетой будет продолжаться. Обедненный озоном воздух посте-пенно рассеивается, газы в атмосфере перемешиваются, содер-жащиеся в воздухе хлорфторуглеводороды будут еще очень дол-го, не менее чем 100 лет, продолжать свою работу, разрушаю-щую озон.В 1990 г. представители правительства 92 стран в Лондоне подписали соглашение о полном прекращении производства хлорфторуглеводородов к 2000 г. Соблюдение этого соглашения будет условием постепенного восстановления природного содер-жания озона в цтратосфере, потому что концентрация уже по-павшего в атмосферу хлора должна со временем уменьшаться, однако это время - столетие.IX. Заключение. Итак, мы получили различные сведения из области химии элементов VI группы и в большей степени о кислороде, узнали о том, где и как применяют и получают кислород, также узнали о воздействии кислорода на нашу жизнь, народное хозяйство и культуру.Если после чтения моего реферата у вас возникло желание по-ближе познакомиться с необъятной областью той науки, откуда почерпнуты сведения по элементам VI группы пе-риодической системы Д. И. Менделеева, то я выпол-нила свою задачу.X. Литература. 1. Химия. Для школьников ст. классов и поступающих в вузы: Учеб. Пособие / Н. Е. Кузьменкою, В. В. Еремин, В. А. Попков - 4-е изд., стереотип. - М.: Дрофа, 2001. - 544 с.:ил.2. Книга для чтения по неорганической химии. Кн. для учащихся. В 2 ч. Ч. 1 / сост. В. А. Крицман - 3-е изд. - М.: Просвещение, 1993. - 192 с., 8 л ил.: ил. - ISBN 5-09-002972-53. Химия. Учеб. для 9 кл. сред. шк. / Ф. Г. Фельдман, Г. Е. Рудзитис - М.: Просвещение, 1990. - 176 с.: ил. ISBN 5-09-002624-64.
Кислород (лат Oxygenium, от греч. oxys кислый и gennao - рождаю) О, хим. элемент VI гр. периодич. системы, ат. н. 8, ат. м. 15,9994. Природный кислород состоит из трех стабильных . 16 О (99,759%), 17 О (0,037%) и 18 О (0,204%]. Конфигурация внешней электронной оболочки 2s 2 2p ; энергии ионизации О°:О + :О 2+ равны соответственно 13,61819, 35,118 эВ; по Полингу 3,5 (наиболее электроотрицательный элемент после F); 1,467 эВ; 0,066 нм. Молекула кислород двухатомна. Существует также аллотропная модификация кислорода – озон О 3 . Межатомное расстояние в молекуле О 2 0,12074 нм; энергия ионизации О 2 12,075 эВ; сродство к электрону 0,44 эВ; энергия 493,57 кДж/моль, константа К р =p O 2 /p O2 составляет 1,662.10 -1 при 1500 К, 1,264.10 -2 при 3000 К, 48,37 при 5000 К; О 2 (в скобках указаны координац. числа) 0,121 нм (2), 0,124 нм (4), 0,126 нм (6) и 0,128 нм (8).
В основном состоянии (триплетное ) два валентных молекулы О 2 , находящиеся на разрыхляющих p х и p у, не спарены, благодаря чему кислород .агнитен (единств, .агнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. температуре (закон Кюри). Существуют два долгоживущих О 2 - синглетное 1 D g (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное (энергия возбуждения 156,8 кДж/моль).
Кислород - наиболее распространенный элемент на Земле. В содержится 23,10% по массе (20,95% по объему) свободного кислорода, в и литосфере - соотв. 85,82 и 47% по массе связанного кислорода. Известно более 1400 . в состав которых входит кислород. Убыль кислорода в в результате . в т. ч. , гниения и дыхания, возмещается выделением кислорода растениями при . Кислород входит в состав всех веществ, из которых построены живые организмы; в организме человека его содержится окислород 65%.
Свойства. Кислород - бесцветный без запаха и вкуса. Т. кип. 90,188 К, температура 54,361 К; плотность при 273 К и нормальном 1,42897 г/л, плотн. (в кг/м 3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); t крит 154,581 К, р крит 5.043 МПа, d крит 436,2 кг/м 3 ; С 0 p 29,4 Дж/(моль.К); DH 0 исп 6,8 кДж/моль (90,1 К); S O 299 205,0 Дж/моль.К); уравнение температурной зависимости давления . в интервале 54-150 К lgp (гПа)=7,1648-377,153/T; 0,02465 Вт/(м.К) при 273 К; h 205,23 10 -7 Па.с (298 К).
Жидкий кислород окрашен в голубой цвет; плотность 1,14 г/см 3 (90,188 К); C O p 54,40 Дж/(моль.К); 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10 -2 Па.с; g 13,2.10 -5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10 -3 (1 - T/154,576) 11/9 Н/м; n D 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магнитная восприимчивость 7,699.10 -3 (90,1 К).
Твердый кислород существует в нескольких кристаллических модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрированной ромбической решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см 3), при 23,89-43,8 К-b-форма с гексаген, кристаллической решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный кислород: температура 283 К, давление 5,0 ГПа; DH O пл 443 Дж/молъ; ур-ние температурной зависимости плотности d= 1,5154-0,004220T г/см 3 (44 54 К), a-, b- и g- О 2 светло-синего цвета. Модификация р антиферромагнитна, a и g .агнитны, их магн. восприимчивость соотв. 1,760 . 10 -3 (23,7 К) и 1,0200 . 10 -5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа кислород кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а =0,42151 нм, b= 0,29567 нм, с =0,66897 нм, плотн. 2,548 г/см 3).
Растворимость кислорода при атмосферном и 293 К (в см 3 /см 3): в 0,031, 0,2201, 0,2557, 0,2313; растворимость в при 373 К 0,017 см 3 /см 3 ; растворимость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители кислород платиновая чернь и активный . в расплавленном состоянии поглощают значительные количества кислорода, например при 960 °С один объем поглощает ~22 объема кислород, который при охлаждении почти полностью выделяется. Способностью поглощать кислород обладают мн. твердые и оксиды, при этом образуются нестехиометрические соединения.
Кислород отличается высокой хим. активностью, образуя соединения со всеми элементами, кроме Не, Ne и Аr. Атом кислород в химических соединениях обычно приобретает электроны и имеет отрицательный эффективный заряд. Соединения, в которых электроны оттягиваются от кислород, крайне редки (напр., OF 2). С простыми веществами, кроме Au, Pt, Xe и Кr, кислород реагирует непосредственно при обычных условиях или при нагревании, а также в присутствии катализаторов. Реакции с проходят под действием электрического разряда или УФ излучения. В реакциях со всеми простыми веществами, кроме F 2 , кислород является .
Молtrekzhysq кислород образует три различные ионные формы, каждая из которых дает начало классу соед.: О - 2 - супероксидам, О 2 2- - пeроксидам (см. . Пе-роксидные соединения органические), О + 2 - диоксигенильным соeдинениям. Озон образует .ды, в которых ионная форма кислород-О - 3 . О 2 присоединяется как слабый к некоторым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет . который осуществляет перенос кислород в организме теплокровных.
Реакции с кислородом, сопровождающиеся интенсивным выделением энeргии, называют горением. Большую роль играют взаимодействие кислорода с металлами в присутствии влаги-атм. . а также дыхание живых организмов и гниение. В результате гниения сложные орг. вещества погибших животных и растений превращаются в более простые и в конечном счете в СО 2 и волу.
С водородом кислород реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н 2). При комнатной температуре реакция идет крайне медленно, в присутствии - сравнительно быстро уже при 80-100 °С (эту реакцию используют для очистки Н 2 и инертных газов от примеси О 2). Выше 550 °С реакция Н 2 с О 2 сопровождается .
Из элементов I гр. наиб. легко реагируют с кислород Rb и Cs, которые самовоспламеняются на воздухе, К, Na и Li реагируют с кислород медленнее, реакция ускоряется в присутствии паров воды. При сжигании (кроме Li) в кислород образуются пероксиды М 2 О 2 и супероксиды МО 2 . С элементами подгруппы IIа кислород реагирует сравнительно легко, например, Ва способен воспламеняться на при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты реакции в этих случаях - и пероксиды. С элементами подгруппы IIб кислород взаимод. с большим трудом, реакция кислород с Zn, Cd и Hg происходит только при более высоких температурах (известны породы, в которых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие от дальнейшего .
Элементы III гр. реагируют с кислород только при нагревании, образуя оксиды. Компактные Ti, Zr, Hf устойчивы к действию кислород С углеродом кислород реагирует с образованием СО 2 и выделением тепла (394 кДж/моль); с аморфным углеродом реакция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом кислород реагирует лишь выше 1200°С с образованием NO, который далее легко окисляется кислород до NO 2 уже при комнатной температуре. Белый фосфор склонен к самовозгоранию на при комнатной температуре.
Элементы VI гр. S, Se и Те реагируют с кислородом с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой температуре.
Кислород энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате реакции кислород с углеводородами.
Получение. В промышленности кислород получают воздуха разделением, гл. обр. методом низкотемпературной ректификации. Его производят также наряду с Н 2 при пром. электролизе воды. Выпускают газообразный технол. кислород (92-98% О 2), техн. (1-й сорт 99,7% О 2 , 2-й сорт 99,5% и 3-й сорт 99,2%) и жидкий (не менее 99,7% О 2). Производится также кислород для лечебных целей ("медицинский кислород", содержащий 99,5% O 2).
Для в замкнутых помещениях (подводные лодки, космические аппараты и др.) используют твердые источники кислород, действие которых основано на самораспространяющейся экзотермической реакции между носителем кислород (хлоратом или перхлоратом) и горючим. Например, смесь NaClO 3 (80%), порошка Fe (10%), ВаО 2 (4%) и стекловолокна (6%) прессуют в виде цилиндров; после поджигания такая кислородная свеча горит со скоростью 0,15-0,2 мм/с, выделяя чистый, пригодный для кислород в кол-ве 240 л/кг (см. Пиротехнические источники газов ).
В лаборатории кислород получают разложением при нагревании оксидов (напр., HgO) или кислородсодержащих солей (напр., КСlO 3 , КМnО 4), а также электролизом водного раствора NaOH. Однако чаще всего используют пром. кислород, поставляемый в баллонах под давлением.
Определение. Концентрацию кислород в газах определяют с помощью ручных газоанализаторов, например волюмометрическим методом по изменению известного объема анализируемой пробы после поглощения из нее О 2 растворами - медноаммиачным, пирогаллола, NaHSO 3 и др. Для непрерывного определения кислород в газах применяются автоматические термомагнитные газоанализаторы, основанные на высокой магнитной восприимчивости кислород Для определения малых концентраций кислород в инертных газах или водороде (менее 1%) используют автоматич. термохим., электрохим., гальванич. и др. газоанализаторы. С этой же целью применяют колориметрич. метод (с использованием прибора Мугдана), основанный на окислении бесцв. аммиачного комплекса Cu(I) в яркоокрашенное соед. Cu(II). Кислород, растворенный в воде, определяют также колориметрически, например по образованию красного окрашивания при окислении восстановленного индигокармина. В орг. соед. кислород определяют в виде СО или СО 2 после высокотемпературного пиролиза анализируемого вещества в потоке инертного газа. Для определения концентрации кислород в стали и сплавах используют электрохим. датчики с твердым электролитом (стабилизированный ZrO 2). См. также Газовый анализ, Газоанализаторы .
ОПРЕДЕЛЕНИЕ
Кислород - восьмой элемент Периодической таблицы. Обозначение - О от латинского «oxygenium». Расположен во втором периоде, VIА группе. Относится к неметаллам. Заряд ядра равен 8.
Кислород - самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе, в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Массовая доля кислорода в земной коре составляет около 47%.
В виде простого вещества кислород представляет собой бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1 л воздуха 1,293г. Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0 o С растворяют 4,9, а при 20 o С - 3,1 объема кислорода.
Атомная и молекулярная масса кислорода
ОПРЕДЕЛЕНИЕ
Относительная атомная масса A r - это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12 (12 С).
Относительная атомная масса атомарного кислорода равна 15,999 а.е.м.
ОПРЕДЕЛЕНИЕ
Относительная молекулярная масса M r - это молярная масса молекулы, отнесенная к 1/12 молярной массы атома углерода-12 (12 С).
Это безразмерная величина.Известно, что молекула кислорода двухатомна - О 2 . Относительная молекулярная масса молекулы кислорода будет равна:
M r (О 2) = 15,999 × 2 ≈32.
Аллотропия и аллотропные модификации кислорода
Кислород может существовать в виде двух аллотропных модификаций - кислорода О 2 и озона О 3 (физические свойства кислорода описаны выше).
При обычных условиях озон - газ. От кислорода его можно отделить сильным охлаждением; озон конденсируется в синюю жидкость, кипящую при (-111,9 o С).
Растворимость озона в воде значительно больше, чем кислорода: 100 объемов воды при 0 o С растворяют 49 объемов озона.
Образование озона из кислорода можно выразить уравнением:
3O 2 = 2O 3 - 285 кДж.
Изотопы кислорода
Известно, что в природе кислород может находиться в виде трех изотопов 16 O (99,76%), 17 O (0,04%) и 18 O (0,2%). Их массовые числа равны 16, 17 и 18 соответственно. Ядро атома изотопа кислорода 16 O содержит восемь протонов и восемь нейтронов, а изотопов 17 O и 18 O- такое же количество протонов,девять и десять нейтронов соответственно.
Существует двенадцать радиоактивных изотопов кислорода с массовыми числами от 12-ти до 24-х, из которых наиболее стабильным является изотоп 15 О с периодом полураспада равным 120 с.
Ионы кислорода
На внешнем энергетическом уровне атома кислорода имеется шесть электронов, которые являются валентными:
1s 2 2s 2 2p 4 .
Схема строения атома кислорода представлена ниже:
В результате химического взаимодействия кислород может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
О 0 +2e → О 2- ;
О 0 -1e → О 1+ .
Молекула и атом кислорода
Молекула кислорода состоит из двух атомов - О 2 . Приведем некоторые свойства, характеризующие атом и молекулу кислорода:
Примеры решения задач
ПРИМЕР 1
Кислород является родоначальником главной подгруппы VI группы (VIA группы) Периодической системы Д. И. Менделеева.
Элементы этой подгруппы - кислород О, сера S, селен Se, теллур Те, полоний Ро - имеют общее название «халькогены», что означает «рождающие руды». (Вспомните, с какими рудами, содержащими кислород и серу, вы уже познакомились.)
![]()
Рис. 108.
Получение кислорода в лаборатории разложением пероксида водорода и собирание его методом вытеснения воды
С некоторыми аспектами химии кислорода вы уже частично знакомы. Получение кислорода из пероксида водорода (рис. 108) и перманганата калия (рис. 109) вы разбирали в прошлом году (вспомните эти реакции).

Рис. 109.
Получение кислорода в лаборатории разложением перманганата калия и собирание его методом вытеснения воздуха
Вы теперь хорошо знакомы и с аллотропией кислорода, вам известно такое важное простое вещество, как озон. (Сравните ещё раз свойства кислорода O 2 и озона O 3 , вспомните биологическое значение озона.)
Кислород - самый распространённый элемент на нашей планете. Он входит в состав воды (88,9%), которая покрывает 2/3 поверхности земного шара, образуя его водную оболочку - гидросферу. Кислород - вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли - атмосферы, где на его долю приходится 20,95% по объёму и 23,15% по массе. Кислород входит в состав многочисленных минералов твёрдой оболочки земной коры - литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов.
Как вы уже знаете, кислород существует в форме O 2 . Это газ без цвета, запаха. В жидком состоянии имеет светло-голубую окраску, в твёрдом - синюю. В воде газообразный кислород растворим лучше, чем азот и водород.
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов. Например, энергично реагирует с металлами: щелочными, образуя оксид с литием Li 2 O и другие продукты, например пероксиды М 2 O 2 ; с железом, образуя железную окалину Fe 3 O 4 ; с алюминием (запишите соответствующие уравнения реакций, рассмотрите окислительно-восстановительные процессы).
Реакции металлов и неметаллов с кислородом протекают очень часто с выделением большого количества теплоты и сопровождаются воспламенением - реакции горения. (Запишите уравнения реакций горения серы с образованием SO 2 , фосфора - с образованием Р 2 O 5 и угля - с образованием СO 2 .)
Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 2000 °С или при электрическом разряде:
Кислород энергично окисляет не только простые, но и многие сложные вещества, при этом образуются оксиды элементов, из которых они построены:

Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах дыхания (рис. 110), медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счёт которой живёт организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин - оксигемоглобин - доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом оксид углерода (IV) (углекислый газ) и воду и освобождая энергию, необходимую для деятельности организма.

Рис. 110.
Газообмен в лёгких и тканях
Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идёт только процесс поглощения растениями кислорода, то на свету протекает ещё один противоположный ему процесс - фотосинтез (рис. 111), в результате которого растения поглощают углекислый газ и выделяют кислород.

Рис. 111.
Фотосинтез
Так как процесс фотосинтеза идёт более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зелёных растений, хотя изначально атмосфера нашей планеты была другой. Рисунок 112 показывает историю возникновения современной атмосферы Земли.

Рис. 112.
Образование современной атмосферы
Круговорот кислорода в природе иллюстрирует рисунок 113.

Рис. 113.
Круговорот кислорода в природе
Повторим ещё раз, что в промышленности кислород получают из жидкого воздуха, а в лаборатории - разложением пероксида водорода Н 2 O 2 в присутствии катализатора - оксида марганца (IV) МnO 2 , а также разложением перманганата калия КМnO 4 при нагревании.
Лабораторный опыт № 27
Получение и распознавание кислорода
Кислород применяют в металлургической и химической промышленности для ускорения (интенсификации) производственных процессов. Так, замена воздушного дутья кислородным в доменном и сталеплавильном производстве намного ускоряет выплавку металла. Чистый кислород применяют также для получения высоких температур, например при газовой сварке и резке металлов. Его используют для жизнеобеспечения на подводных и космических кораблях, при работах водолазов, пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Кислород хранят в стальных баллонах, окрашенных в голубой цвет (рис. 114, а), под давлением 150 атм. В лабораторных условиях кислород хранят в стеклянном приборе - газометре (рис. 114, б).

Рис. 114.
Хранение кислорода:
а - стальной баллон; б - газометр
Основные области применения кислорода представлены на рисунке 115.

Рис. 115.
Применение кислорода:
1 - в металлургии; 2 - как окислитель ракетного топлива; 3 - в авиации для дыхания; 4 - в медицине для дыхания; 5 - при взрывных работах; 6 - для газовой резки и сварки металлов
Открытие кислорода . Кислород открыли и впервые получили почти одновременно два выдающихся химика XVIII в. - швед К. Шееле путём нагревания селитры и англичанин Дж. Пристли при нагревании оксида ртути (II). Название oxygenium, т. е. «рождающий кислоты», или «кислород», этому элементу дал великий французский химик А. Лавуазье.
Новые слова и понятия
- Кислород в природе.
- Химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами.
- Горение и медленное окисление.
- Дыхание и фотосинтез.
- Получение кислорода.
- Применение кислорода.
Задания для самостоятельной работы
- Напишите уравнения реакций кислорода с металлами, о которых говорится в параграфе. Рассмотрите окислительно-восстановительные процессы.
- Напишите уравнения реакций кислорода с неметаллами, о которых говорится в параграфе. Рассмотрите окислительно-восстановительные процессы.
- Какие вещества называются катализаторами? Какая реакция, применяемая для получения кислорода, осуществляется в присутствии оксида марганца (IV)? Напишите уравнение этой реакции.
- Английский химик Дж. Пристли получил кислород разложением оксида ртути (II). Напишите уравнение этой реакции. Придумайте и решите задачу, в условии которой были бы указаны масса исходного вещества и доля в нём примесей, а требовалось бы найти объём кислорода при известном выходе его от теоретически возможного.
- Укажите признаки сходства и различия в процессах дыхания и горения.
- Сравните процессы дыхания и фотосинтеза.
- Используя свои знания по химии кислорода, напишите сочинение на тему «Художественный образ вещества или процесса».
- Напишите уравнение реакции фтора с водой. В какой роли здесь выступает кислород? Рассмотрите окислительновосстановительный процесс, определите окислитель и восстановитель.
Кислород
КИСЛОРО́Д -а; м. Химический элемент (O), газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду.
◊ Перекрыть кислоро́д кому-л. Создать невыносимые условия жизни, работы.
◁ Кислоро́дный, -ая, -ое. К-ая среда. К-ые соединения. К-ая резка (газовая резка). К-ая сварка (газовая сварка). К-ое голодание; к-ая недостаточность (мед.; понижение содержания кислорода в тканях организма; гипоксия).
◊ Кислоро́дная подушка (см. Поду́шка).
кислоро́д(лат. Oxygenium), химический элемент VI группы периодической системы. В свободном виде встречается в виде двух модификаций - О 2 («обычный» кислород) и О 3 (озон). О 2 - газ без цвета и запаха, плотность 1,42897 г/л, t пл –218,6ºC, t кип –182,96ºC. Химически самый активный (после фтора) неметалл. С большинством других элементов (водородом, галогенами, серой, многими металлами и т. д.) взаимодействует непосредственно (окисление) и, как правило, с выделением энергии. При повышении температуры скорость окисления возрастает и может начаться горение. Животные и растения получают необходимую для жизни энергию за счёт биологического окисления различных веществ кислородом, поступающим в организмы при дыхании. Самый распространённый на Земле элемент; в виде соединений составляет около 1 / 2 массы земной коры; входит в состав воды (88,8% по массе) и многих тканей живых организмов (около 70% по массе). Свободный кислород атмосферы (20,95% по объёму) образовался и сохраняется благодаря фотосинтезу. Кислород (или обогащённый им воздух) применяется в металлургии, химической промышленности, в медицине, кислородно-дыхательных аппаратах. Жидкий кислород - компонент ракетного топлива.
КИСЛОРОДЭнциклопедический словарь . 2009 .
Синонимы :Смотреть что такое "кислород" в других словарях:
- (Охуgenum). Бесцветный газ без запаха и вкуса. Мало растворим в воде (приблизительно 1:43). Ингаляциями кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией: при заболеваниях органов дыхания (пневмония, отек легких … Словарь медицинских препаратов




